
- 20maggio
-
Il sistema UDI per i DM e gli IVD
UDI è l’acronimo di Unique Device Identifier e definisce un codice alfanumerico che permette l’identificazione e, di conseguenza, una migliore tracciabilità puntuale di ogni dispositivo medico presente sul mercato. Il codice UDI è composto da una parte statica (DI) che identifica il dispositivo (es. modello e fabbricante) e una parte dinamica (PI) che identifica la produzione dello stesso (es. lotto e unità di produzione)
L’applicazione di tale codifica interessa ogni livello di confezionamento e imballaggio del dispositivo, dalla singola unità venduta fino all’imballaggio di spedizione. Questo, oltre a facilitare la tracciabilità dei dispositivi in tutte le loro fasi (dalla fabbricazione alla mesa in commercio), aiuterà nell’adempimento dei compiti di vigilanza e di sorveglianza sul mercato sia i fabbricanti sia le autorità competenti
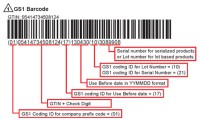
Eistono diversi standard di codifica, anche se il più diffuso è quello del GS1: agenzia indipendente che fornisce i codici alfanumerici ai fabbricanti che ne fanno richiesta; tali codici permettono di non avere duplicazioni indesiderate
Le regole sono state condivise in una linea guida implementata a livello mondiale (linee guida IMDRF) affinché la circolazione delle informazioni possano essere agevolate tra tutti i paesi
Attualmente, esiste una differenza nell’applicazione di tali regole. Mentre negli Stati Uniti per determinati prodotti (di alta classe di rischio come ad es. impiantabili attivi) vige l’obbligo di utilizzo della codifica UDI già dal settembre 2014, in Europa l’UDI sarà ripreso all’interno degli atti delegati previsti dal nuovo Regolamento sui dispositivi medici, attualmente allo studio delle autorità europee ma non ancora in vigore
La codifica UDI, nella sua parte statica, sarà parte fondamentale per la creazione del database europeo dei dispositivi medici (Eudamed) e permetterà a tutti gli Stati Membri di condividere al meglio le informazioni (sulle specifiche tecniche, inerenti le indagini cliniche, relative alla sicurezza, etc.) riguardanti tutti i dispositivi circolanti
Inserito da Redazione 20 mag


Post Comments 0